钙离子作为细胞内关键的第二信使,其浓度动态变化直接反映细胞活性状态,尤其在神经科学、发育生物学等领域的研究中具有不可替代的作用。钙成像技术凭借对钙离子浓度的实时监测能力,成为解析细胞功能的核心手段之一。模式动物的选择是钙成像实验设计的首要环节,小鼠与斑马鱼因各自独特的生物学特性,均在该领域得到广泛应用。
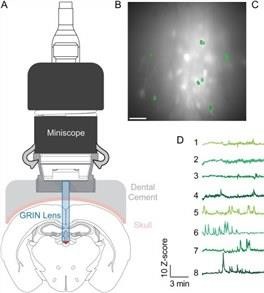
一、小鼠钙成像实验方案设计
1.实验动物的预处理
实验前需对小鼠进行适应性饲养,饲养环境保持温度20-26℃、湿度40%-70%,每日光照与黑暗周期各12小时,自由摄食饮水,适应周期不少于3天。根据实验需求选择合适的小鼠品系,常用近交系如C57BL/6J,或转基因品系如表达GCaMP系列钙指示剂的小鼠。若使用非转基因小鼠,需通过立体定位注射将钙指示剂探针导入目标组织,注射后需静置1-2周,确保探针在细胞内充分表达。
2.成像系统的搭建与参数设定
成像系统核心组件包括激光共聚焦显微镜或双光子显微镜、高灵敏度探测器及图像采集软件。选择488nm激发波长匹配GCaMP系列指示剂,发射光采集波长设定为500-550nm。根据观测目标调整显微镜放大倍数,对单细胞分辨率成像采用60-100倍油浸物镜,对组织层面成像采用10-20倍物镜。扫描速度设定为30-60帧/秒,平衡时间分辨率与图像信噪比;激光功率控制在10-50mW,避免长时间照射导致组织损伤。
3.实验操作与数据采集
采用腹腔注射麻醉剂(如1%戊巴比妥钠,剂量50mg/kg)对小鼠进行麻醉,麻醉后将其固定于立体定位仪或专用成像平台,确保目标组织处于成像视野中心。根据实验类型选择成像方式,活体在体成像需保持小鼠体温稳定在37℃,通过呼吸监测仪实时观察生命体征;离体组织成像需将组织置于含人工脑脊液的培养皿中,维持pH值7.2-7.4,温度35-37℃。数据采集过程中,记录钙信号变化的原始图像及对应的时间序列,采集时长根据实验目的设定为5-60分钟,同时记录实验过程中的环境参数与动物状态。
4.数据处理与分析
利用ImageJ或专用钙成像分析软件对原始数据进行预处理,包括图像去噪、背景扣除及运动校正,消除动物呼吸或轻微移动导致的图像偏移。选取感兴趣区域,提取该区域内荧光强度的时间序列数据,通过ΔF/F0(荧光强度变化量与基线荧光强度的比值)计算钙信号波动幅度。对处理后的数据进行统计分析,包括钙信号发放频率、峰值、半幅持续时间等参数的量化,采用合适的统计方法检验组间差异。
二、斑马鱼钙成像实验方案设计
1.实验动物的预处理
选择发育阶段明确的斑马鱼,常用胚胎期(24-72小时_post fertilization,hpf)、幼鱼期(7-14天_post fertilization,dpf)或成鱼。胚胎及幼鱼可直接使用转基因品系,如全身性表达GCaMP的Tg(β-actin:GCaMP6s)品系;成鱼若需局部成像,可通过显微注射将钙指示剂导入目标部位。实验前将斑马鱼置于28.5℃恒温培养箱中培养,胚胎需在含0.003%苯硫脲的胚胎培养液中培养以抑制黑色素形成,提高成像清晰度。
2.成像系统的搭建与参数设定
基于斑马鱼体型较小的特点,可选用共聚焦显微镜或宽场荧光显微镜搭配高倍物镜。激发波长与发射波长设置同小鼠实验,匹配所使用的钙指示剂。胚胎及幼鱼成像采用20-40倍水浸物镜,成鱼成像根据目标组织深度选择40-60倍水浸物镜或油浸物镜。扫描速度设定为60-100帧/秒,适应斑马鱼部分组织快速的钙信号变化;激光功率控制在5-20mW,避免对发育中的胚胎或幼鱼造成损伤。
3.实验操作与数据采集
胚胎及幼鱼实验无需麻醉,将其置于含3%甲基纤维素的培养皿中固定,调整体位使目标组织朝上;成鱼采用MS-222(三卡因)麻醉,浓度为100-200mg/L,麻醉后固定于定制的硅胶垫上,保持鳃部与水体接触以维持呼吸。
成像过程中,胚胎及幼鱼需保持培养环境温度28.5℃,成鱼水温维持在26-28℃。根据研究目的选择成像时长,发育动态监测可长达数小时,短时信号记录为5-30分钟,同步记录斑马鱼发育阶段或生理状态信息。
4.数据处理与分析
数据预处理步骤与小鼠实验一致,重点针对斑马鱼胚胎发育过程中的形态变化进行图像配准,确保不同时间点感兴趣区域的精准对应。提取荧光强度时间序列后,计算ΔF/F0值量化钙信号变化,针对胚胎发育过程中的钙信号,可结合组织发育时序进行动态关联分析。统计分析聚焦钙信号与发育阶段、生理状态的相关性,量化不同条件下钙信号参数的差异。
三、小鼠与斑马鱼钙成像实验的核心差异比较
1.生物学特性适配性差异
小鼠作为哺乳动物,其器官结构、生理功能与人类高度同源,尤其在神经环路构建、疾病模型构建等方面具有显著优势,适合开展与人类疾病相关的钙成像研究。但小鼠体型较大,活体成像时组织穿透力要求高,需依赖双光子显微镜等高端设备,且实验周期较长,饲养成本较高。
斑马鱼胚胎及幼鱼通体透明,无需复杂的样品处理即可实现全身组织的高分辨率成像,发育周期短,繁殖能力强,可在短时间内获得大量实验样本,适合高通量筛选及发育过程中的钙信号动态监测。但其脊椎动物进化地位低于小鼠,部分生理机制与人类存在差异,限制了部分疾病相关研究的直接应用。
2.实验设计关键环节差异
预处理方面,小鼠需根据是否为转基因品系选择立体定位注射或直接使用,麻醉操作是必需步骤且需严格控制剂量;斑马鱼胚胎及幼鱼可利用透明性直接成像,无需麻醉,成鱼麻醉剂量较低,转基因品系的应用更为便捷。
成像系统方面,小鼠成像对设备穿透力、分辨率要求更高,常需搭配专用的活体成像平台;斑马鱼胚胎及幼鱼可使用宽场荧光显微镜完成部分实验,设备成本相对较低。
数据采集方面,小鼠实验需重点监测生命体征,避免麻醉意外影响实验结果;斑马鱼则需关注温度、水质等环境因素对发育及钙信号的影响。
3.研究应用场景差异
小鼠钙成像实验主要应用于神经科学领域的环路功能解析、学习记忆机制研究,以及心血管疾病、肿瘤等疾病模型中的细胞活性监测。
斑马鱼则更适用于发育生物学中器官发生过程的钙信号调控研究,药物筛选中的细胞毒性及作用机制初步评估,以及环境污染物对生物体早期发育影响的监测。在神经科学领域,斑马鱼可用于简单神经环路的发育研究,而小鼠则在复杂神经功能研究中更具优势。
小鼠与斑马鱼在钙成像实验方案设计需紧密结合自身生物学特性与研究目的。小鼠凭借与人类的高度同源性,在疾病机制研究与复杂功能解析中占据不可替代的地位;斑马鱼则以透明性、短发育周期等特点,在发育监测与高通量研究中展现独特价值。明确两种模式动物的实验设计要点及差异,有助于研究者根据研究需求选择合适的实验对象,优化实验方案。